ACS Nano新突破:类器官生物传感平台精准捕捉膀胱癌化疗诱导侵袭,开启个性化预后新路径
来源:生物谷原创 2025-11-17 10:08
本研究开发出膀胱癌类器官生物传感平台,能个体化评估顺铂化疗诱导的肿瘤侵袭风险,明确DLL4为关键标志物、癌相关成纤维细胞具调控作用,为临床个体化治疗提供核心工具。
对临床医生而言,膀胱癌的治疗始终面临两难,它既是全球高发的泌尿系统恶性肿瘤,又因高复发、高进展风险让治疗方案的选择充满挑战。数据显示,约75%的膀胱癌患者初诊时为非肌层浸润性(NMIBC),即便接受经尿道膀胱肿瘤电切术(TURBT)这一标准治疗,仍有40%患者会在两年内复发,10%-45%可能进展为更凶险的肌层浸润性膀胱癌(MIBC);而MIBC患者即便接受激进治疗,复发率仍高达50%,且复发多为晚期病变。
化疗是贯穿膀胱癌各治疗阶段的核心手段:低危NMIBC患者术后需单次膀胱内化疗,高危患者可能用卡介苗(BCG)联合化疗,MIBC则需顺铂为基础的新辅助化疗,但化疗的问题同样突出:不仅副作用显著,近年研究还发现,它可能通过改变肿瘤微环境、诱导上皮间质转化等方式,反而增强部分肿瘤的侵袭性和转移潜能。这种“化疗悖论”,让临床亟需能精准评估个体化疗风险的工具。近日,发表于ACS Nano的一项研究,恰好针对性开发出一种类器官生物传感平台,为解决这一难题提供了新路径。

这种平台的设计思路紧贴临床需求:以TURBT手术获取的患者肿瘤样本为基础,直接制备新鲜分离的肿瘤类器官和自组装微肿瘤,再将其置于模拟膀胱基底膜的“肿瘤-凝胶”仿生微环境中培养。平台的核心优势在于整合了两项关键技术,活体单细胞纳米生物传感器与3D延时显微镜,既能实时检测肿瘤内分子标志物的变化,又能快速捕捉肿瘤侵袭的动态过程,且无需复杂传代,最大程度保留了原始肿瘤的结构和细胞组成,甚至能应对少量临床样本的分析需求。
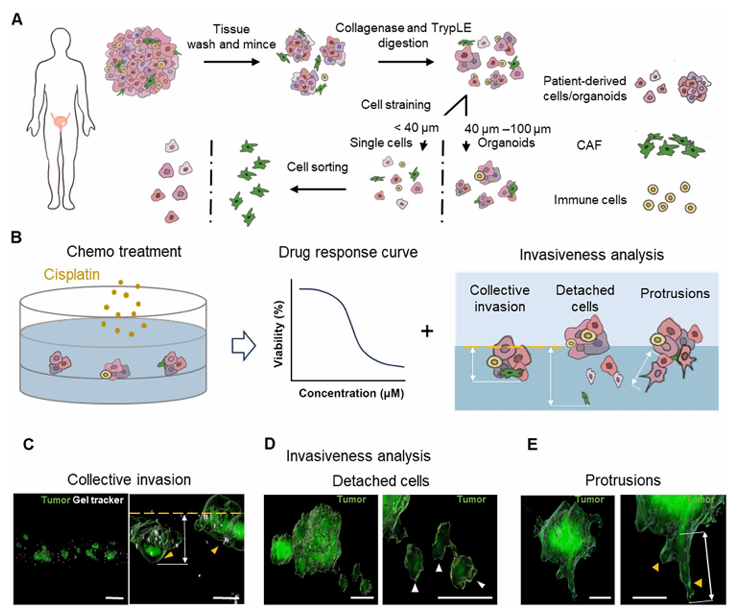
图 1. 类器官生物传感平台评估化疗耐药性和化疗诱导侵袭风险的示意图
为验证平台可靠性,研究团队先从膀胱癌细胞系入手。他们选取了临床中最常见的两种亚型:基底型(SCaBER)和管腔型(RT4)。分子检测显示,SCaBER高表达KRT5、KRT14等基底标志物,而RT4不仅强表达PPARG、FOXA1等管腔标志物,还因NRF2水平较高而自带化疗耐药倾向。药物反应实验证实了这一点:SCaBER对顺铂更敏感,半数抑制浓度(IC₅₀)仅26.25μM;RT4则表现出明显耐药,IC₅₀达46.47μM。更关键的侵袭性分析发现,顺铂处理后,RT4细胞的侵袭深度几乎翻倍,而SCaBER仅在高浓度顺铂下呈现轻微侵袭增强趋势,这一结果清晰证明,平台能精准区分不同亚型细胞对化疗的反应差异。
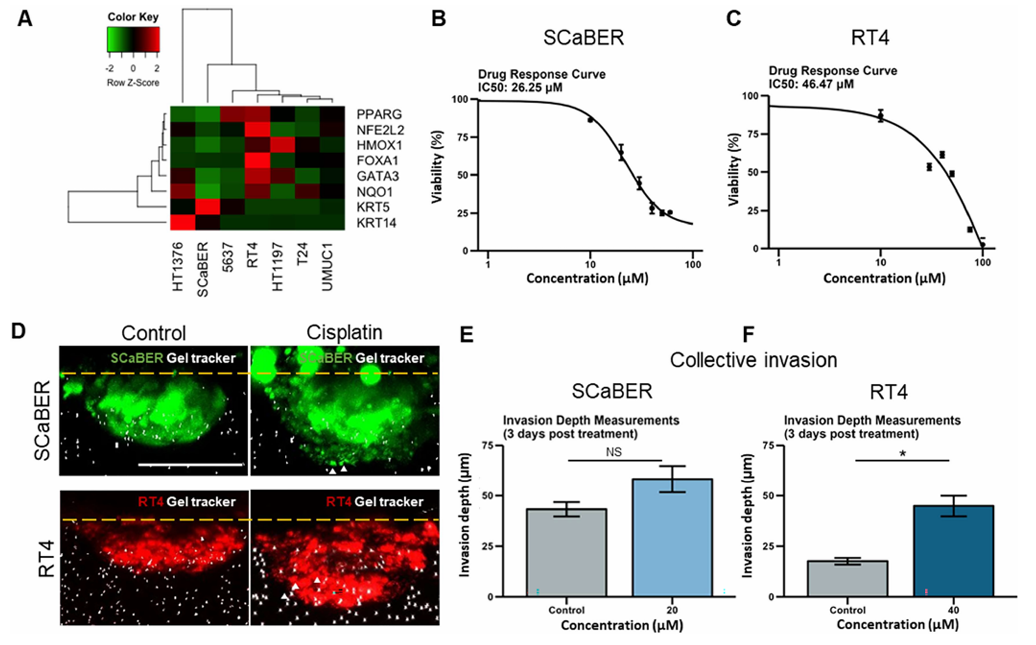
图2. 膀胱癌细胞系对类器官生物传感平台的表征
临床样本验证是平台落地的关键。研究团队收集了11例膀胱癌患者的TURBT样本,排除运输延误、样本量不足等问题后,剩余9例样本均成功通过平台完成分析。无论是新鲜分离的类器官,还是由少量细胞组装的微肿瘤,都表现出一致的化疗反应趋势。新鲜类器官的优势在于能快速反映原始肿瘤的治疗响应,而自组装微肿瘤则可灵活加入特定细胞成分(如癌相关成纤维细胞CAFs),解决了临床少量样本难以反复实验的痛点。
实验结果带来了重要临床启示:56%(5/9)的患者样本在顺铂处理后出现了明确的“化疗诱导侵袭”,且侵袭模式各不相同,有的表现为整个类器官集体向凝胶内侵袭,有的是单个癌细胞从类器官脱落、独立穿透基质,还有的会形成细长的“突起”延伸入凝胶;而另外44%的样本,无论是否用顺铂处理,均未观察到明显侵袭增强。比如高分级T2期的PPS1样本,顺铂处理后出现典型的集体侵袭;高分级T1期的PPS2样本则以脱落细胞侵袭为主,部分细胞甚至能穿透到培养孔底部(约1毫米深度);而同样是高分级T2期的PPS3样本,无论有无顺铂,均未表现出明显侵袭。这些差异充分说明,膀胱癌对顺铂的侵袭响应存在显著个体异质性,必须个体化评估。
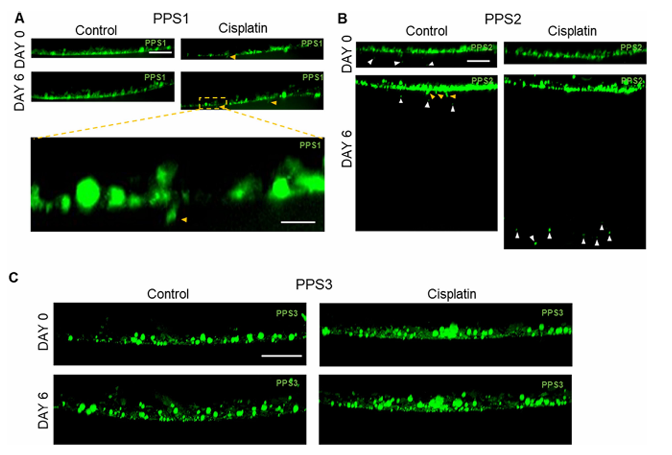
图3. 新鲜分离膀胱癌类器官化疗诱导侵袭风险评估
研究还进一步厘清了肿瘤微环境的作用,CAFs在化疗诱导侵袭中扮演着“双向调控者”角色。以PPS3样本为例,当把CAFs从肿瘤细胞中分离后,顺铂处理组的侵袭深度和脱落细胞数量明显增加;但当CAFs与癌细胞重新共培养时,顺铂诱导的集体侵袭被显著抑制,仅脱落细胞数量仍有上升。这一发现提示,CAFs对膀胱癌侵袭的影响并非单一促进,而是存在复杂调控机制,也体现了该平台解析肿瘤微环境相互作用的独特价值。
在分子机制层面,研究找到了关键的“侵袭信号”DLL4。作为侵袭性“领导细胞”的标志性分子,DLL4的表达变化能直接反映肿瘤侵袭状态。通过纳米生物传感器检测发现,顺铂处理后,微肿瘤侵袭前沿的细胞、以及脱落的单个癌细胞中,DLL4表达均显著升高;且在有侵袭性的样本(如PPS2)中,这种升高更明显。时间序列观察还发现,DLL4的表达具有动态性:当它的水平下降时,原本延伸出的肿瘤突起会逐渐回缩,这意味着DLL4不仅可作为评估侵袭风险的标志物,还可能成为干预靶点。
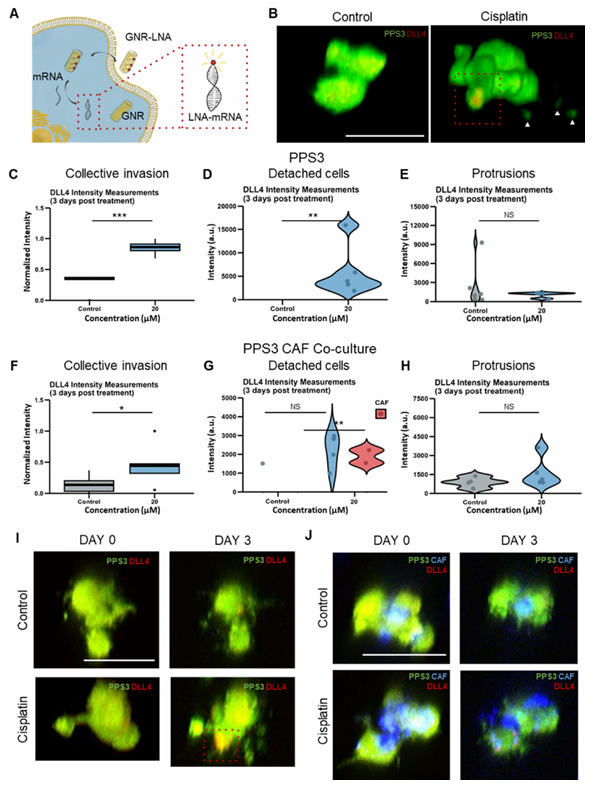
图4. 自组装微肿瘤中化疗增强的DLL4表达
对临床而言,这项研究不只是一项技术突破,它为膀胱癌治疗提供了“个体化预警工具”。未来,医生可能通过术前或术后的少量肿瘤样本,借助该平台快速判断:患者是否适合顺铂化疗?化疗后是否存在侵袭风险升高?再结合DLL4等标志物的检测,为患者定制“风险可控”的治疗方案,比如对高侵袭风险患者,及时调整化疗方案或联合抗侵袭治疗,在控制肿瘤的同时规避潜在风险。
对膀胱癌患者来说,这意味着“一刀切”的化疗模式可能逐渐成为过去。借助这类精准平台,每个患者都能获得更贴合自身病情的治疗方案,既避免无效化疗带来的副作用,也减少因“化疗悖论”导致的病情进展风险。随着平台进一步优化和临床验证,膀胱癌的个体化治疗将迈出更坚实的一步,为改善患者长期预后提供新的希望。(生物谷Bioon.com)
参考文献:
Yan Y, Ahmed M, Mach KE, Liao JC, Wong PK. An Organoid Biosensing Platform for Personalized Prognosis of Bladder Cancer. ACS Nano. 2025;19(44):38305-38317. doi:10.1021/acsnano.5c09883
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


